Disturbo dello Spettro Autistico – ASD. Ambiente e variazioni epigenetiche
L’autismo è un disturbo dello sviluppo neurologico a esordio precoce e, nella maggior parte dei casi, permanente, attualmente diagnosticato attraverso test comportamentali standardizzati di età compresa tra 2 e 4 anni. Il Disturbo dello spettro autistico (ASD) è identificato come un’alterazione nella comunicazione e nell’interazione sociale , si manifesta con comportamenti ripetitivi, un modello di interessi limitato e anomalie sensoriali . L’ esordio precoce più comune è rappresentato da caratteristiche atipiche nel linguaggio vocale-verbale e nello sviluppo socio-comunicativo ed una diminuita capacità di abilità attorno al primo anno di vita . Alcuni bambini mostrano inizialmente un periodo di sviluppo apparentemente tipico, seguito da una perdita di abilità precedentemente stabilite. Il fenomeno è definito “regressione” e si manifesta tra i 15 ei 30 mesi di età, con una media di 21 mesi. Numerose caratteristiche emotive e cognitive, contribuiscono all’ampia variabilità del quadro clinico e al vario impatto sulle principali aree della vita . Un aumento significativo negli ultimi anni nell’incidenza di ASD fa supporre che i fattori ambientali e lo stile di vita contribuiscano assieme alla predisposizione individuale a tale aumento..
Attualmente, molte aree mediche sono impegnate nella ricerca sull’ASD, tra cui genetica, epigenetica, immunogenetica, immunologia, microbiologia e biochimica , quest’ultima, in particolare, per quanto riguarda la compromissione mitocondriale e lo stress ossidativo. La complessità biologica alla base delle anomalie comportamentali spiega un disturbo sistemico, non limitato al cervello, ma che coinvolge anche altri organi e sistemi
I risultati epidemiologici e clinici nell’ASD non possono essere spiegati dal modello genetico lineare tradizionale, da qui la necessità di muoversi verso una concezione più fluida, integrando genetica, ambiente ed epigenetica nel suo complesso.
il ruolo attivo dell’ambiente nel modulare la salute della persona e della sua progenie
Il feto è particolarmente vulnerabile ai cambiamenti ambientali esterni ed interni.
«ciò che avviene nei nove mesi di gestazione può essere più importante di quanto avverrà nel corso della vita». Prof. Ernesto Burgio
Il periodo embrio-fetale e i primi due anni di vita (i cosiddetti “primi 1000 giorni”) sono la finestra temporale cruciale per lo sviluppo neurologico. In particolare, l’interazione tra attivazione immunitaria, disbiosi intestinale, e la compromissione mitocondriale / stress ossidativo influisce in modo significativo sul neurosviluppo durante la gravidanza e coinvolge la salute delle persone con ASD per tutta la vita. Di conseguenza, la complessità biologica dell’ASD necessita di un intervento efficace dato dalla prevenzione primaria mirata alla gestione della gravidanza e al controllo precoce con strategie preventive efficaci e approccio sanitario personalizzato, dinamico, sistemico con esigenze di salute multilivello e interdisciplinare.
La programmazione neurale fetale, che si verifica durante l’ontogenesi, e la neuroplasticità dal vivo precoce sono eventi cruciali nel neurosviluppo e identificano la finestra temporale della massima opportunità cerebrale nel periodo embrio-fetale e nei primi due anni di vita (i cosiddetti ‘primi 1000 giorni )
In questo periodo temporale, gli insulti esogeni ei cambiamenti nell’ambiente materno sembrano avere il massimo effetto di disturbo e conseguenze per tutta la vita sulla salute. Il meccanismo molecolare dinamico coinvolto nell’ontogenesi trasforma gli input della prima infanzia in risultati a lungo termine, influenzando le vie enzimatiche e immuno-neuroendocrine, che definiscono le basi dell’omeostasi durante la vita intrauterina e postnatale .
Il disturbo multisistemico dello sviluppo neurologico sembrano essere meglio rappresentati da una traiettoria di fragilità possibile e modificabile , almeno in parte, piuttosto che da un’immagine statica risultante da un danno cerebrale fisso e inevitabile, ciò incoraggia gli sforzi per strategie efficaci di prevenzione primaria indirizzate ai “primi 1000 giorni”, al fine di trasformare questa finestra temporale nella migliore opportunità di prevenzione per la salute umana .
Per quanto riguarda il neurosviluppo, l’impatto massimo si verifica nei primi due anni di vita, che è la finestra temporale cruciale per il cablaggio cerebrale.
Genetica, epigenetica e ambiente quali influenze
Studi genetici quantitativi, inclusi studi sui gemelli, hanno suggerito un ruolo della genetica nell’ASD, suggeriscono la necessità di discostarsi da un modello genetico lineare legato alle patologie monogeniche di tipo mendeliano. Il notevole aumento negli ultimi anni della prevalenza di ASD rende non plausibile l’ipotesi di un numero crescente di malattie monogeniche e per questo motivo si è pensato un modello epigenetico molto più fluido.
L’epigenetica descrive la riprogrammazione fisiologica che avviene nelle cellule senza modificare la sequenza delle basi del DNA, attraverso una serie di meccanismi biochimici e genetici che comprendono la metilazione del DNA, modifiche a livello degli istoni, attività di regolazione dell’ mRNA
Le alterazioni epigenetiche sono sempre più riconosciute come un ruolo importante nella patogenesi di un numero crescente di malattie . Le principali variazioni del nostro fenotipo (sia fisiologico che patologico) hanno origine nella programmazione fetale, sono indotte dall’ambiente e modulate dall’epigenoma.
 Per epigenetica si intende un nuovo modello genomico sistemico che pone la sequenza del DNA al centro di una rete molecolare dinamica, fluida, unitaria e interattiva, coinvolgendo l’ambiente interno ed esterno. Il genoma è proposto come un sistema fluido, costituito dalla sequenza del DNA, dalla struttura istonica reattiva e dalle informazioni provenienti dall’ambiente circostante, nel senso più ampio del termine.
Per epigenetica si intende un nuovo modello genomico sistemico che pone la sequenza del DNA al centro di una rete molecolare dinamica, fluida, unitaria e interattiva, coinvolgendo l’ambiente interno ed esterno. Il genoma è proposto come un sistema fluido, costituito dalla sequenza del DNA, dalla struttura istonica reattiva e dalle informazioni provenienti dall’ambiente circostante, nel senso più ampio del termine.
Il modello integra DNA (hardware), ambiente (informazioni) ed epigenetica (software). L’epigenetica si riferisce ai cambiamenti nei meccanismi di regolazione genica che sono indipendenti dall’alterazione delle sequenze codificanti del DNA sottostanti.
Pertanto, l’attenzione viene spostata dalla sequenza di DNA umano altamente conservata filogeneticamente al modo alterato con cui vengono lette le istruzioni memorizzate.
L’epigenoma è il software che attiva e disattiva i geni, è coinvolta nell’embriogenesi per la formazione dei tessuti rendendoli specializzati per la loro funzione, sintonizza la corrispondenza tra l’informazione proveniente dall’esterno (ambiente) e l’informazione codificata da milioni di anni nel DNA (cioè l’hardware). Questo lo fa attraverso meccanismi che modulano la programmazione, la trascrizione e la traduzione del messaggio, l’epigenoma orchestra i cambiamenti strutturali e funzionali di cellule e tessuti, contribuendo all’evoluzione del fenotipo, sia in situazioni fisiologiche che patologiche. Quando l’ambiente inteso sia come interno che esterno all’organismo agisce producendo cambiamenti l’epigenetica sintonizza l’espressione genica sulla base dei cambiamenti nell’ambiente cellulare, in senso adattivo e predittivo, predisponendo sistemi molecolari cellulari finalizzati all’omeostasi. La metilazione del DNA è uno dei meccanismi epigenetici più comuni. I cambiamenti nelle “firme epigenetiche” durante la fase di sviluppo sintonizzano finemente la differenziazione delle cellule precursori nel loro specifico stato maturo , pertanto, i marcatori epigenetici mostrano un livello relativamente alto di plasticità durante i periodi di differenziazione cellulare, incluso il neurosviluppo Poiché il periodo embrio-fetale ei primi due anni di vita rappresentano la finestra temporale di massima neuroplasticità, ci si aspetta che l’esposizione ambientale che si verifica durante la gravidanza porti a modificazioni a lungo termine nei pattern epigenetici e abbia il massimo impatto sul neurosviluppo .
Una disregolazione epigenetica può coinvolgere e riguardare malattie immuno-allergiche, infiammatorie, metaboliche, cronico-degenerative, neurosviluppate, neuropsichiatriche, neurodegenerative e neoplastiche a cui stiamo assistendo sempre più negli ultimi decenni.
Poiché questo lasso di tempo è troppo breve per essere imputato a meccanismi di mutazioni genetiche classiche è più plausibile che l’aumento rifletta i cambiamenti nella programmazione genica (epigenetica) indotti da un numero crescente di fattori di stress ambientali durante il periodo critico finestre in sviluppo . Questa interpretazione è alla base della teoria dell’origine epigenetica / embrio-fetale delle malattie (DOHaD – Developmental Origin of Health and Diseases) .
La teoria DOHaD suggerisce una prospettiva sistemica, al fine di spiegare le ragioni della profonda trasformazione della salute e della malattia umana. La teoria prende in considerazione l’impatto dei fattori di stress ambientali sulle modificazioni epigenetiche reattivo-adattive e predittive (programmazione fetale) nel differenziamento cellulare e tissutale, con conseguenze a lungo termine sullo sviluppo individuale e sull’impatto transgenerazionale. Anche la corrispondenza imperfetta tra la programmazione embrio-fetale e l’ambiente postnatale (cioè, la mancata corrispondenza tra la previsione prenatale e l’effettivo ambiente postnatale) potrebbe contribuire all’insorgenza di malattie non trasmissibili
Durante la gravidanza, la placenta “traduce” l’ambiente esterno al feto attraverso adattamenti molecolari epigenetici, in particolare modificando la metilazione dei geni impressi, che agiscono come controllori chiave per lo sviluppo fetale. Una vasta gamma di input materni (ad esempio, sovra e sottoalimentazione, fumo, assunzione di droghe e alcol, tossici ambientali, infezioni e stress) può indurre cambiamenti nella fisiologia placentare, che vanno dalle alterazioni della morfologia e del peso placentare, a quelle più sottili cambiamenti nell’espressione genica placentare, che coinvolgono segnali importanti diretti al feto.
La programmazione epigenetica è altamente sensibile ai cambiamenti nell’ambiente cellulare. In effetti, la regolazione epigenetica è un meccanismo adattivo ampiamente utilizzato, che consente alle cellule di mantenere uno stato metabolico favorevole in diverse condizioni, inclusa l’esposizione a sostanze fisiologiche (p. Es., Ormoni, neurotrasmettitori o fattori di regolazione della crescita), xenobiotici (p. Es., Inquinanti, sostanze chimiche tossiche. ), o anche agenti infettivi (ad esempio, batteri o virus, funghi o parassiti) La regolazione epigenetica può facilitare l’adattamento ai cambiamenti nell’ambiente cellulare attraverso alterazioni stabili del fenotipo cellulare, potenzialmente con conseguente differenziazione e maturazione progressiva durante lo sviluppo fetale e postnatale ( teoria D.Barker e modelllo di P. Gluckman).
Durante l’ontogenesi, il software epigenetico è programmato in senso adattivo e predittivo, guidando la differenziazione cellulare e configurando le vie metaboliche, immunologiche ed endocrine per l’omeostasi permanente. Per quanto riguarda il neurosviluppo, i “primi 1000 giorni” sono il periodo in cui la neuroplasticità è più viva, per proliferazione, differenziazione, migrazione, sinaptogenesi e potatura neuronale. In altre parole, questa è la finestra di tempo più vulnerabile per il cablaggio del connettoma individuale i “primi 1000 giorni” offrono un’opportunità unica per fornire il miglior contesto per la migliore traiettoria permanente nel neurosviluppo .
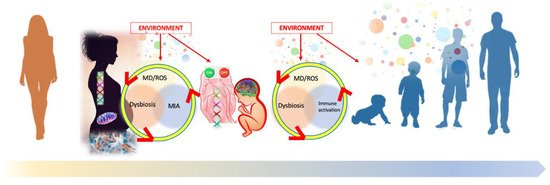
I risultati della letteratura suggeriscono nell’ASD l’esistenza di un circolo vizioso tra disbiosi, risposta immunitaria e disfunzione mitocondriale / stress ossidativo, un “ cattivo trio ” che potrebbe iniziare dal periodo embrio-fetale, influenzare il neurosviluppo e persino potrebbe causare un progressivo peggioramento del disturbo neurologico.
L’ASD richiede urgentemente un approccio dinamico e personalizzato
La conoscenza della crescente complessità dei percorsi eziopatogenetici delle malattie è la premessa per un adeguato adattamento delle strategie di prevenzione, diagnosi e cura secondo l’evoluzione dei bisogni di salute della popolazione. Nei disturbi del neurosviluppo, in particolare nell’ASD, la maggior parte dei metodi statistici attuali non sembrano adatti a studiare interazioni non lineari, complesse e sfocate che coinvolgono genoma, epigenoma, fattori ambientali e interazione nervoso-immunitario-endocrino, e per farlo lungo un percorso che inizia anche prima del concepimento.
Lo sviluppo del cervello embrio-fetale è profondamente influenzato da numerosi fattori ambientali interagenti, denominati “esposomi” nel loro insieme. Sia nella vita intrauterina che in quella postnatale, le informazioni ambientali convergono su tre principali percorsi di interazione / sovrapposizione: disbiosi, compromissione mitocondriale / stress ossidativo e attivazione immunitaria (chiamata MIA durante la gravidanza).
Ci si aspetta che i fattori prenatali influenzino lo sviluppo più di tutti gli altri e non siano limitati al solo cervello. Il fenotipo sfaccettato e l’endofenotipo trovati nelle persone con ASD sono coerenti con un disturbo multisistemico e in evoluzione. il rischio di squilibrio nutrizionale sembra essere alto nelle persone con ASD e potrebbe, almeno in parte, spiegare risultati coerenti con la sindrome metabolica e stress ossidativo Pertanto, evidenze convergenti suggeriscono di includere esperti nutrizionali nel panel di professionisti del modello sanitario rivolto alle persone con ASD. Infatti, oltre all’apporto energetico, la dieta ha un impatto sul microbiota], sulla funzione immunitaria [ 276 ] e sul profilo della membrana cellulare lipidica]. In altre parole, la dieta influisce sulla maggior parte dei meccanismi patogenetici fondamentali dimostrati nell’ASD. Coerentemente, un piano dietetico personalizzato e monitorato può svolgere un ruolo centrale nelle strategie preventive e nella cura dell’ASD. ottenere la diagnosi precoce di qualsiasi anormalità biologica che possa avere un impatto sullo sviluppo neurologico, al fine di ripristinare il miglior equilibrio il prima possibile, si spera nel periodo di massima neuroplasticità
Un approccio multidisciplinare e la condivisione interdisciplinare della conoscenza sembrano essere l’unico modo per rispondere alle loro esigenze complesse, suggerisce un modello sanitario interdisciplinare. Durante la gravidanza, il ginecologo assicura il miglior controllo dei fattori di rischio e il potenziamento dei fattori protettivi, in gran parte legati alla corretta alimentazione e integrazione materna. L’intervento più efficace nell’ASD è previsto dalla prevenzione primaria mirata alla gravidanza e al controllo precoce delle principali vie molecolari effettrici. strategie preventive efficaci e approccio sanitario personalizzato, dinamico (dal grembo materno all’età adulta), sistemico e interdisciplinare.
Questo approccio non vale solo per l’autismo ma anche per le altre patologie emergenti come la sindrome metabolica , che non si manifesta così presto nell’infanzia, ma più avanti nella vita con pesanti coinvolgimenti sulla salute.
E’ ormai noto che lo stile di vita gioca un ruolo cruciale nella salute riproduttiva e transgenerazionale
Le coppie che desiderano un concepimento devono cercare di modificare le loro abitudini spesso inadeguate attraverso cambiamenti comportamentali ricerca di un modo ed un ambiente il più possibile sano in cui vivere. L’attenzione alla salute della madre è la premessa per una vita intrauterina di qualità. Queste informazioni debbono essere date alla coppia che intende iniziare una gravidanza.
Da J. Pers. Med. 2021 , 11 (2), 70